top of page
Ley de rapidez
Es la relación entre la velocidad de reacción y las concentraciones de todas las sustancias presentes en el medio racional, así como a todos los demás factores susceptibles de influir en la velocidad.
Teoría del estado de transición
Fue expuesta en 1935 por el químico H. Eyring.
Las moléculas de los reactivos que chocan quedan unidas momentáneamente y forman un compuesto
Velocidad de reacción
Representa la rapidez con que tiene lugar la transformación química de unas sustancias, los reactivos; en otras distintas, los productos.

Determinación de la velocidad media
La reacción entre el cloruro de yodo y el hidrógeno, en estado gaseoso:
2 ICl (g) + H2 (g) → I2 (g) + 2 HCl (g)
Su velocidad puede determinarse mediante cualquiera de las siguientes expresiones:

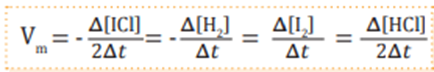
Refuerza tu conocimiento


Velocidad instantánea

Es la velocidad de reacción en un momento determinado

Ecuación de velocidad
Se centra en el análisis de la relación que existe entre la velocidad y las concentraciones de las sustancias
Orden de la reacción
Permiten clasificar las reacciones desde el punto de vista cinético
Temperatura de reacción
La elevación de la temperatura produce el aumento de la velocidad de la reacción
Naturaleza, estado físico y grado de división
Un metal como el sodio, con baja energía de ionización y gran poder reductor, tiende a oxidarse más rápidamente que el oro

Concentración de reacctivos
Forma general de expresarla
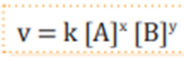
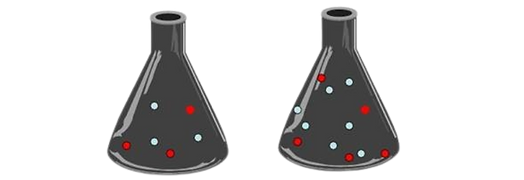
Las sustancias cuyos átomos se unen mediante enlaces covalentes reaccionan más lentamente que las sustancias iónicas
El vapor de gasolina se quema instantáneamente y de forma explosiva, mientras que el líquido se quema con menor rapidez

bottom of page