Rapidez de reacción
La velocidad de reacción se define como la cantidad de sustancia que se transforma en una determinada reacción por unidad de tiempo.
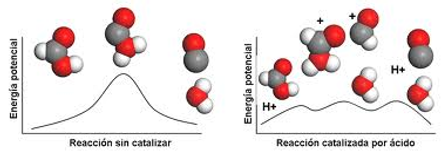
La parte de la química que trata los aspectos relacionados con lavelocidad de las reacciones es la cinética química, y esta:
-
Mide la velocidad de las reacciones.
-
Investiga las etapas o fases a través de las cuales transcurre unareacción, es decir, el mecanismo de la reacción.
-
Estudia los factores que pueden influir en dicha velocidad
EJEMPLOS DE VELOCIDAD DE LA REACCIÓN
Oxidación del hierro (corrosión)
La oxidación del hierro, comúnmente conocida como corrosión o óxido, es un proceso químico donde el hierro se oxida en presencia de oxígeno y humedad, formando óxido de hierro

Reacción del ácido clorhídrico y el zinc

La reacción entre el ácido clorhídrico y el zinc para producir cloruro de zinc e hidrógeno es relativamente rápida.
Teoría de las reacciones químicas
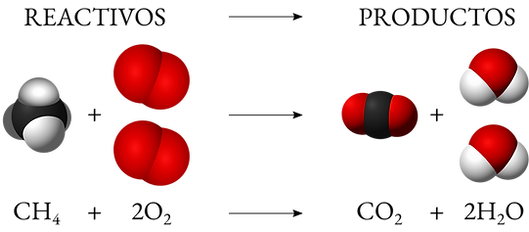

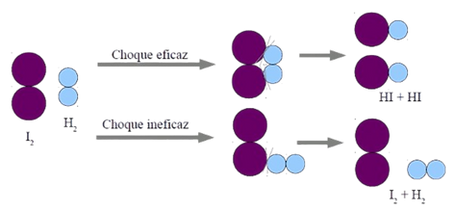
Hay reacciones lentas y rápidas y por qué ciertos factores son capaces de modificar la velocidad de las reacciones,conviene conocer qué sucede con las moléculas de las sustanciascuando reaccionan.
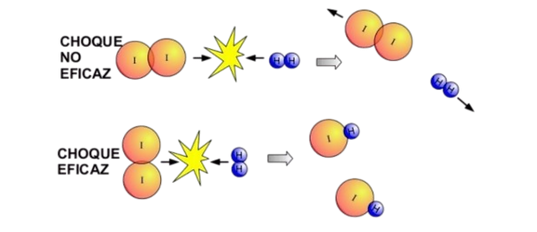
Teoría de las colisiones
Teoría cinético-molecular

Afirma que una reacción química se produce como resultado del choque de dos o más moléculas
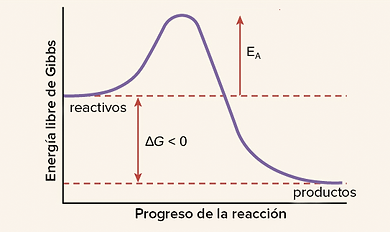
Energía de activación
